人蚊之战
作者:袁越
08-27·阅读时长52分钟

向蚊子宣战
利物浦位于英国西海岸,曾经是大英帝国最重要的港口城市。我从阿尔伯特码头出发,沿着一条主干道向东走了一公里,便来到了利物浦热带医学院(Liverpool School of Tropical Medicine)。这所医学院成立于1898年,是全世界第一家致力于研究热带病的科研机构,无数艘从大英帝国殖民地返回的商船为这家医院提供了源源不断的病例。
医学院的老楼仍在,但只具有象征意义了,绝大部分实验室都搬到了旁边新建的一幢玻璃大楼内。新楼的一层是个很小的会客厅,上空悬挂着一只巨大的玩具蚊子,红色的肚子胀得鼓鼓的,显然是一只刚吸完血的雌蚊。最早把蚊子和热带病联系在一起的英国医生罗纳德·罗斯(Ronald Ross)就是这家医学院的一名研究员,他在1897年8月20日这天在蚊子体内发现了疟原虫的踪迹,证明蚊子才是传播疟疾的罪魁祸首。这一天后来被命名为世界蚊子日,而罗斯本人则因为这个发现获得了1902年度的诺贝尔生理学或医学奖,成为第一个获得诺奖的英国人。
如果单从拯救生命这个角度来衡量,罗斯的这个发现毫无疑问是最重要的诺奖,没有之一,因为蚊子是人类的头号杀手,同样没有之一。根据《命运之痒:蚊子如何塑造人类历史》(The Mosquito: A Human History of Our Deadliest Predator)一书的作者,加拿大著名历史学家蒂莫西·瓦恩加德(Timothy Winegard)所做的统计,自现代智人诞生于非洲开始,20万年来一共有大约1080亿人曾经来到人间,其中大约520亿人死于蚊子传播的各类传染病,也就是说大约有一半的地球人都是被蚊子杀死的。
蚊子之所以如此厉害,原因在于它们已经在地球上进化了很多年,经受过沧海桑田的严酷考验。2023年底,中国科学院南京地质古生物研究所的黎巴嫩籍研究员丹尼·阿扎(Dany Azar)在两块距今大约1.3亿年的黎巴嫩琥珀中发现了已知最古老的蚊子化石,证明早在白垩纪早期就有蚊子在吸血了。分子生物学研究甚至把蚊子的诞生日期提前到了距今2亿年前的侏罗纪早期,说明蚊子很可能是和恐龙一起进化而来的,电影《侏罗纪公园》里的那个从蚊子肚子里提取恐龙DNA的设定是有可能成立的。
现代智人虽然只有20万年的历史,但因为人类的扩张速度非常快,很快就被聪明的蚊子盯上了。蚊子军团最致命的杀手无疑是按蚊(Anopheles),这是蚊科下面的一个属,其中有大约30种能够传播疟疾,因此也被称为疟蚊。疟疾是历史上致死人数最多的传染病,前文提到的520亿死亡人数当中的绝大多数都是被疟原虫(Plasmodium)杀死的。


蚊子军团第二致命的杀手是伊蚊(Aedes),因为身体上有斑纹,又称花斑蚊或者虎斑蚊。伊蚊能够传播的疾病种类很多,大家耳熟能详的黄热病(yellow fever)、西尼罗热(west nile)、寨卡热(zika)、登革热(dengue)、基孔肯雅热(chikungunya),以及很多不同种类的脑炎都是通过伊蚊传播的。
蚊子军团第三致命的杀手是库蚊(Culex),这是绝大部分居民室内最常见的蚊子,几乎所有人都被它咬过,因此又称家蚊。库蚊是丝虫病和日本脑炎的传播者,但大部分常见的库蚊并不传播疾病,只是一种令人讨厌的存在而已。
按蚊和伊蚊比较喜欢炎热的气候,所以疟疾和黄热病等传染病都被称为热带病。古人不明原理,常常把这类传染病的病因归因于所谓的“瘴气”,并因此而对热带雨林和沼泽湿地充满了恐惧。人类历史上的很多重大事件都受到了热带病的影响,比如亚历山大大帝的那次东征就是因为印度疟疾而被迫终止的,后来的数次十字军东征也是如此;大英帝国之所以决定把罪犯流放到澳大利亚而不是非洲,就是因为当时的澳大利亚没有疟疾;美国独立战争之所以如此顺利,也和英军士兵对热带病缺乏抵抗力有一定的关系。事实上,整个美洲的独立都有蚊媒传染病的“功劳”,而非洲内陆之所以在很长一段时间内都未被欧洲殖民者攻陷,原因也和热带病有关。
远古时代的人类缺乏科学知识和趁手的工具,只能依靠自身的免疫系统应对热带病。比如一部分非洲人进化出了镰刀型贫血症,用杀敌一千自损八百的方法对付疟原虫。文明诞生之后,住在尼罗河边的古埃及人学会了用渔网当蚊帐,阴差阳错地躲过了灭顶之灾。秘鲁原住民则意外地发现金鸡纳树皮可以治疗疟疾,欧洲人随后从这种树皮中提炼出了奎宁,人类终于有了第一种治疗疟疾的特效药。可惜疟原虫逐渐进化出了对奎宁的抗性,疟疾再次泛滥。据统计,1920年代全球平均每年疟疾感染高达8亿次,造成350万至400万人死亡。1931年中国长江洪灾导致受灾地区60%的民众感染疟疾,30万人因此死亡。

眼看治疗疟疾的特效药逐一失效,大家终于意识到只有掐断传染源才能有效地控制疟疾的暴发,于是各国政府不约而同地把工作重点转向了灭蚊,毕竟猎杀野生动物才是人类的强项。
可以毫不夸张地说,人类的进化史就是一部动物猎杀史,我们是踩着动物的尸体爬上地球之王宝座的。早年间古人依靠狩猎大体型动物获取宝贵的动物蛋白,发明出农业之后又不得不采取各种措施控制农业害虫,其中绝大多数都是昆虫。作为昆虫家族的一员,蚊子的生活史相当复杂,虫卵先要在水中孵化成孑孓,后者必须在水中生活一段时间才能羽化成蚊,这就给人类提供了一个显而易见的目标。自20世纪初期开始,很多国家不约而同地开展了清除湿地和城市积水的卫生运动,实在清除不了的池塘或者沼泽就只能往里面喷洒各种杀虫剂,或者干脆倾倒汽油或煤油来防止孑孓的羽化。
这方面最为典型的事件就是意大利法西斯独裁者墨索里尼于两次世界大战间隔期间在意大利蓬蒂内沼泽地(Pontine Marshes)实施的一次大胆的灭蚊行动,他试图借助这场“沼泽之战”彰显国家法西斯党的强大执行力。蓬蒂内位于意大利中西部的拉齐奥大区,因地势较低而遍布沼泽,据说当年一个人只要在沼泽地里待上一天,便有80%的概率染上疟疾。墨索里尼征召了12.5万名工人开进沼泽地,把积水全部抽干,并建造堤坝控制河流,把这块湿地改造成了农田。纳粹党还强制所有新建的房屋全都安装了纱窗,并为当地人发放免费的奎宁。单从疟疾防控的角度讲,这场战役取得了巨大的成功,意大利的疟疾发病率在短短7年的时间里下降了99.8%。
不过,一般国家都不会也没有复制法西斯党独裁下的执行力,所以大部分国家最终还是依靠新型杀虫剂打败了生命力顽强的蚊子。其中效果最显著的无疑是1939年投入使用的广谱杀虫剂滴滴涕(DDT)。无论哪个国家,只要用上了滴滴涕,疟疾病例便会直线下降。比如南美洲因使用滴滴涕,疟疾病例在1942~1946年间下降了35%,印度的疟疾病例在使用滴滴涕的10年间从7500万例下降至5万例,斯里兰卡的疟疾病例更是从滴滴涕使用前的每年300万例下降到只有29例。

放眼全球,蚊媒传染病的感染数量在1930~1970年这40年里减少了90%,欧洲更是在1975年宣布彻底根除了疟疾,所有这些成果都是在人口总数翻了一番的情况下取得的,滴滴涕无疑是最大的功臣。
眼看人蚊之战即将以人类大获全胜而告终,美国作家瑞秋·卡森(Rachel Carson)于1962年出版了《寂静的春天》,首次向公众报告了滴滴涕对环境的危害。原来,这种广谱杀虫剂不但可以杀死蚊子,还可以毫无差别地杀死几乎所有的昆虫。凡是大面积使用滴滴涕的地方,不但蚊子跳蚤这样的害虫没有了,就连蜜蜂和蝴蝶这样的益虫也都被杀光了。更可怕的是,滴滴涕还会导致蛋壳软化,影响鸟类的繁殖,甚至对某些鱼类也有很高的毒性。
这本书在全世界引发了强烈反响,各国政府纷纷修改相关法律,禁止使用滴滴涕。没想到,这一禁令立刻导致疟疾疫情出现反弹,比如斯里兰卡的疟疾病例迅速回升至每年50万,印度的这一数字也迅速升高到每年650万,中东和中亚地区的蚊媒传染病感染率也回到了滴滴涕使用前的水平。
因为这个原因,有人开始质疑卡森的那本《寂静的春天》的价值,认为这本书间接杀死了很多人。支持者则相信这本书开启了世界环保运动,功德无量。不管怎样,滴滴涕对大自然的破坏是绝对不能被忽视的,人类不可能生活在一个没有昆虫和鸟类的世界里。我们应该做的就是想办法利用滴滴涕的高效灭蚊优点,尽可能地避免伤及无辜。事实上,世界卫生组织(WHO)于2006年重新推荐了滴滴涕,但只能在室内使用。
与此同时,科学家们也在加紧研制新型抗疟药物,继奎宁之后陆续推出了伯氨喹(primaquine)、氯喹(chloroquine)、多西环素(doxycycline)和甲氟喹(mefloquine)等特效药,以及在中国家喻户晓的青蒿素(artemisinin),其功效可以说是各有千秋。为了延缓抗药性的出现,科学家们建议采用复方制剂,比如目前比较流行的一种复方制剂包含青蒿素、甲氟喹和苯芴醇(lumefantrine)这3种药物,分别针对疟原虫的不同生命阶段,药效非常显著。

新药的使用,以及居民生活环境和卫生条件的改善,使得全球蚊媒传染病的发病率在经历了短暂的上升之后再次逐年下降。截止到目前,全球一共有105个国家和地区获得了WHO的无疟疾认证。除了大多数发达国家之外,这份名单里还包括斯里兰卡、马尔代夫、阿尔及利亚、毛里求斯、突尼斯和摩洛哥等40多个发展中国家,中国也于2021年实现了消除疟疾的目标。这些国家用实际行动证明,人类完全可以在不使用滴滴涕的情况下,仅靠提高公共健康水平和整顿环境卫生等常规措施就能战胜疟疾这种蚊媒传染病。
但是,全球疟疾发病率在连续下降了近10年之后于2015年开始再次出现反弹,此后一直稳步上升。2022年全球一共报告了2.49亿疟疾病例,比2021年增加了500万例,比2019年新冠暴发前的流行水平更是高出了1600万例。2022年全球一共有大约60.8万人死于疟疾,80%为5岁以下儿童。95%的疟疾感染和死亡病例发生在撒哈拉以南非洲,每年给非洲大陆造成大约120亿美元的经济损失。
除了政治动乱和局部战争之外,造成此次疟疾发病率反弹的最大原因就是蚊子对各种灭蚊措施产生了抗性。除了滴滴涕之外,目前最常用的灭蚊剂就是各类除虫菊酯和避蚊胺(DEET),蚊子已经对它们产生了一定程度的抗药性。再加上除虫菊酯有一定的毒性,每年都会发生多起小孩因误食电蚊香液而中毒的病例,某种程度上影响了灭蚊药的普及。蚊帐虽然既安全又有效,但传播疟疾的按蚊逐渐改变了习性,白天也开始咬人了,导致蚊帐的防御效果大打折扣。再加上部分非洲国家的老百姓不相信蚊子会传播疾病,把国际社会无偿捐赠的蚊帐改作渔网,这就进一步增加了防疫难度。
除此之外,疟原虫也对各类抗疟药物产生了抗药性。再加上现有疟疾疫苗的保护期太短,效果也不够好,所有这些因素叠加在一起导致了最近的这次疟疾反弹。2022年的全球疟疾发病率仍然维持在每千人58.4例的水平,远远偏离WHO定下的到2025年降至每千人26.2例的目标。
更可怕的是,随着气候变化的加剧,蚊子开始向高纬度高海拔地区扩散,顺便把此前只在热带地区才有的蚊媒传染病带了过去。据统计,在过去的一个世纪里,按蚊的活动范围平均每年向高海拔地区移动约6.5米,并以平均每年4.7公里的速度从赤道向外扩张。伊蚊也有类似的趋势,其结果就是除了疟疾之外,登革热、寨卡热和脑炎等热带病的发病率也呈上升趋势,影响的范围也越来越广。根据最新的统计,所有这些蚊媒传染病加起来每年平均造成70多万人死亡,其中大部分是发展中国家的儿童。
面对蚊子的猖狂进攻,人类靠什么来应对呢?为了寻找答案,我踏上了寻访灭蚊新武器之路。
新武器之一:昆虫不育
我的第一站是广州。5月的广州已经入夏,白天的气温始终维持在30℃以上。我乘坐的那辆出租车冷气开得很足,但车里居然混进了两只蚊子。
“今年广州雨水特别多,估计会是一个登革热大年。”我的采访对象,中山大学医学院副教授张东京对我说,“做灭蚊产品的商家肯定赚翻了,不过现在市面上那些灭蚊产品都没什么用,效果很差。”
张东京也是做灭蚊产品的,但他的产品本身就是蚊子,只不过都是被核辐射照过的。他希望核辐射能破坏雄蚊的生殖系统,产下不育的后代。
“这个技术叫昆虫不育(Sterile Insect Technique,SIT),已经有将近100年的历史了。”张东京介绍说,“不过早年间科学家们用的是化学试剂,或者从其他地方引入某个具有生殖隔离效果的姐妹种和本地品种进行杂交。现在则主要用辐照来破坏精子的染色体,或者造成受精卵的遗传密码错配,以此来达到让昆虫后代绝育的目的。”

熟悉科学史的读者肯定记得,DNA双螺旋结构是在1953年才被画出来的,之前的科学界并不知道DNA是遗传物质,也不知道核辐照导致不育的机理是什么,但这并不妨碍几位美国科学家于1950年代初期开始尝试用核辐照SIT来消灭农业害虫,比如螺旋蝇和地中海果蝇等,均取得了不错的效果。
具体方法是这样的:先在实验室里大规模培养海量的雄蝇,用核辐照处理一下,然后把它们释放到目标区域,希望它们和野生雌蝇交配,生下一堆不育的卵。
从以上这段叙述可以看出,SIT必须满足以下几个条件才能成立。首先,野生雌蝇不能具备多次交配的能力,否则效果会大打折扣。其次,辐照过的雄蝇必须在求偶过程中具备一定的竞争力,否则效果也会大打折扣。第三,在大多数情况下,经过辐照的雄蝇的竞争力都会有不同程度的下降,这就需要采取淹没战术(inundation technique),也就是以量取胜。换句话说,科学家们必须释放几倍于野生雄蝇数量的辐照雄蝇才能看到效果,这就对雄蝇的大规模生产提出了很高的要求。
螺旋蝇和地中海果蝇均符合上述条件,所以很顺利地获得了各国政府的批准。其中,消灭螺旋蝇的SIT项目在其鼎盛时期每年都要放飞3亿只经过处理的螺旋蝇!结果到1982年时美国本土已经看不到螺旋蝇了,3年后就连墨西哥也没有了螺旋蝇的踪迹。
消灭螺旋蝇很可能是人类历史上最成功的一次灭虫案例。受其鼓舞,很快就有人尝试用同样的方法来消灭蚊子,可惜效果不佳,主要原因就是蚊子的身体太脆弱了,经辐照处理过的雄蚊竞争不过野生雄蚊,于是野生雌蚊仍然会倾向于选择和野生雄蚊交配。
“以前的技术确实不适合蚊子,主要原因就是大规模辐照的质量控制做得不好。”张东京对我说,“经过几年的摸索,我们已经掌握了蚊子的大规模饲养技术,并大幅提高了辐照的质控水平,因此我们的SIT具备了实用条件。”
据张东京介绍,以前大家都是用X射线来照射蚊子的卵,但他们发现这么做会导致位于下层的卵处于缺氧环境,其结果就是射线强度太高会降低蚊子质量,太低又会影响绝育效果,这个平衡点很难把控。经过一番试验后,他们决定改照蚊子成虫,即先用低温让蚊子成虫进入昏睡状态,然后再直接照射,一举解决了这个问题。
“我们对辐照后的雄蚊做过风洞逃逸测试,发现它们的飞行能力和野生雄蚊差不多。”张东京对我说,“我们还做过交配竞争测试,发现辐照雄蚊的竞争力并没有受损太多,完全可用。”
不过,目前这个方法只适用于传播登革热的伊蚊,因为伊蚊的性别二态性很明显,雌蚊和雄蚊的个头存在显著差异,很容易通过机器加以分类。而传播疟疾的按蚊的性别二态性很小,导致机器分类的错误率太高,其结果就是会有大量吸血的雌性按蚊被错误地释放到野外,而这显然是不行的。
之所以必须用机器来进行分类,原因在于SIT需要的蚊子数量太多了。张东京告诉我,要想实现控蚊效果,至少需要一次性释放5倍于目标区域野生蚊子数量的辐照雄蚊,这么多蚊子靠人工分类是不可能的,必须用机器。WHO出版的灭蚊纲要规定,采用SIT技术的蚊子工厂的混雌率不能超过1%,对于按蚊来说很难做到。
另外,伊蚊主要生活在城市里,正好便于集中释放。再加上核辐照SIT的成本很高,发展中国家用不起,所以目前这项技术只在新加坡进行过大规模使用,结果证明这项技术确实能够降低伊蚊的种群数量,新加坡的登革热发病率也因此而下降了70%,效果令人满意。
“辐照SIT技术不但需要建造蚊子工厂,还要雇人去全城释放,释放后的监测工作也需要人手,算下来其综合成本是非常高的。”张东京对我说,“新加坡政府之所以愿意花这笔,是因为他们发现通过SIT技术来控蚊的成本比登革热造成的损失要低,从经济角度讲是划算的。”
中国之所以愿意投资这项技术,一方面是因为中国的核技术本来就很强,用起来很顺手。另一方面,中国国家原子能机构希望通过这项技术让老百姓体会到核技术除了用于核武器和核电站之外,也能为提高普通民众的生活质量做出贡献。除此之外,中国有关部门也希望把这个技术输出到“一带一路”的国家,从而起到一种示范作用。

说到技术输出,发展中国家最迫切的需求并不是控制伊蚊,而是控制按蚊。比如原产于印度的斯氏按蚊(Anopheles stephensi)是印度疟疾的主要传播者,但由于气候变化和人员流动等原因,这种蚊子已经占领了整个阿拉伯半岛,并已开始向北非扩散。更糟糕的是,斯氏按蚊是一种具备城市定殖能力的蚊子,如果这种蚊子入侵非洲的话,会导致大量缺乏免疫力的非洲城镇人口患上疟疾,后果不堪设想。
在国家自然科学基金委和比尔及梅琳达·盖茨基金会的联合资助下,张东京接受了挑战,开始研究如何将辐照SIT技术应用于斯氏按蚊,目前已经取得了很好的效果。比如,为了解决雌雄分离的问题,张东京尝试用含有毒性物质的血喂养蚊子,通过这个方法把吸血的雌蚊清除掉。但是,这个方法会误杀一部分雄蚊,这会影响到蚊子工厂的产量,所以张东京还在尝试其他办法。
不过,无论是伊蚊还是按蚊的辐照SIT,距离实际应用都还很远。据张东京介绍,辐照SIT从技术突破到实际应用需要经过4个阶段,中国仅走到第二阶段,即实验室小规模实验证明有效的阶段。第三阶段是大规模野外释放,科学家们需要在真正的野外环境里收集数据,以此来判断控蚊和疾控效果,推算应用成本(包括生产成本、运输释放成本和监测成本)与控制效益比(蚊媒种群控制效果、减少杀虫剂使用量及使用频率、降低蚊媒疾病发病率等等),再与传统的灭蚊方法比较,看看真实的效益比是否可以被大家接受。
“第三阶段非常重要,因为野外环境复杂多样,存在很多意想不到的变数。无论实验室的数据多么漂亮,都必须经过野外释放的考验才能确认有效。”张东京说,“但第三阶段的开展一来需要大笔的经费,二来需要有相应的监管政策支持,国内目前对这项技术的监管还是空白,所以我们不太敢去野外进行大规模释放。”
“是不是因为老百姓对核技术比较恐惧?”我问。
“我觉得SIT还好,毕竟我们照的是蚊子,不会有环境残留,而雄蚊辐照后通常会死得很快,因此也不大会扩散开来。再加上这个技术有国际原子能机构的背书,专家和民众的接受度还是很高的。”张东京回答,“即便如此,每当我们想要申请野外释放时,总会有一部分人站出来反对,所以我们必须做好社区沟通工作。当年新加坡在全城释放前政府会派人挨家挨户做宣传,电视台也会反复不停地播放科普宣传片,这才终于获得了老百姓的支持。”
确实,几乎每一项灭蚊新技术都遇到过这个问题,民众的不理解往往是科学家们所要面临的最大障碍,尤其是下一个灭蚊武器更是如此,因为这个武器名叫转基因。
新武器之二:转基因
我的第二站是英国约克郡,我的采访对象是约克大学(University of York)遗传系的系主任卢克·艾尔菲(Luke Alphey)教授。他主持开发了全球第一个大规模释放的转基因蚊子,将人蚊之战上升到了一个新的高度。

“我原来是在牛津大学研究果蝇遗传学的,1994年我听说加州大学的安东尼·詹姆斯(Anthony James)首次克隆了一个蚊子基因,便转而研究转基因蚊子。”艾尔菲对我说,“因为我想通过基因工程技术来弥补SIT的不足,最终实现消灭蚊媒传染病的目标。”
在艾尔菲看来,SIT技术的核心就是先在实验室里改变某种动物的遗传特征,然后将其释放到野外,通过有性生殖把这个遗传特征传递给野生动物。因为技术水平的限制,早年间科学家们只能通过放射线照射的方式强行破坏动物的遗传物质,其结果只有一个,那就是让目标动物不孕不育。如果能运用基因工程的手段对实验动物的DNA进行具有针对性的操作,就能把任何特定的基因转移至野生动物体内,从而实现对野生动物种群的精准操控。
转基因说起来似乎很容易,但操作起来困难重重。科学家们首先要对目标物种的遗传特性十分了解,知道哪个基因会带来哪种特性,然后才能从中挑选出适合自己需求的目标基因。2002年,艾尔菲和詹姆斯共同发现了一个专门影响埃及伊蚊(Aedes aegypti)翅膀发育的基因,这个基因不会影响雄蚊,却能让雌蚊的翅膀长不大,于是孵化出来的雌蚊飞不起来,因此也就没办法出去咬人了。
其次,科学家们还必须想办法把外源基因转入目标动物的基因组,这也是很难做到的。艾尔菲带我参观了他的实验室,几位实验员正在显微镜的帮助下用一根针头将装有外源基因的溶液注入蚊子的卵。不用说,这个操作相当困难,操作员的双手稳定性不足,必须借助一套精细的机械传动装置才能完成。
艾尔菲用类似的装置成功地将这个翅膀发育基因转入了埃及伊蚊,构建出了第一个具备野外释放潜力的转基因蚊子。于是他和朋友一起成立了一家名为Oxitec的生物科技公司,试图利用这项技术来控制有害昆虫,比如蚊子和农业害虫等等,比尔及梅琳达·盖茨基金会为这家初创公司提供了500万美元的启动资金。

但是,正如前文所说,SIT控蚊技术需要释放海量的雄蚊才能实现,这就必须让携带该基因的雌蚊仍然可以正常发育,否则蚊子工厂就没办法大批量生产转基因蚊子了。于是艾尔菲为这个翅膀发育基因设计了一个特殊的基因开关,当环境中存在四环素时这个开关处于关闭状态,雌蚊便可以正常发育了。只有当环境中没有了四环素时,这个开关才会被打开,阻碍雌蚊翅膀的发育。野外环境里没有四环素,所以在野外孵化的雌蚊全都没有翅膀,不可能存活下来。
为了便于研究人员监控野外释放的效果,艾尔菲又给这种蚊子转入了一个荧光蛋白基因,让所有被转了基因的蚊子都能在特殊光源的照射下发出绿光。
即便拥有了这些保险措施,但当Oxitec试图申请大规模野外释放研究时却仍然遇到了麻烦,因为当时正值农业转基因技术遭遇大规模争议,很多民众对转基因这个名字产生了恐惧心理,不愿让科学家们在自己的地盘做实验。

“其实X射线诱发的昆虫基因突变完全是随机的,很可能导致一些不可预知的结果,而我们的转基因SIT技术要比X射线精准得多,也比杀虫剂更有专一性,不会影响环境中的其他物种。”艾尔菲对我说,“公众没有理由反对转基因,除非大家不想杀蚊子了。”
确实,衡量一种新技术的好坏,最合理的办法就是和它所要替代的旧技术作对比,而不是单独把新技术拎出来挑毛病。转基因蚊子比辐照蚊子或者杀虫剂更安全,公众没有理由反对前者而支持后两者。类似的案例还有辐射育种和转基因育种之间的对比,两者都是对基因的改变,前者的改变完全是随机的,不但更容易出问题,而且育种的精准度更差,需要花费更长的时间才能获得所需性状。但民众却对转基因育种技术横加指责,反而对辐射育种没有异议,这是毫无道理的。
当然了,作为一项全新的技术,转基因SIT必须证明自己比旧技术更有效,性价比也更高才行。但如果各国政府都不允许野外试验的话,科学家们就无法知道这项新技术是否可行。
“其实写出《寂静的春天》的卡森也是支持利用生物技术防控害虫的,毕竟蚊子杀死了很多人,不解决这个问题是不人道的。”艾尔菲对我说,“卡森反对滴滴涕的原因并不是因为它消灭了蚊子,而是因为它在消灭蚊子的同时杀死了很多其他生物,破坏了生态环境,所以我们所要做的就是提高灭蚊的专一性。化学杀虫剂很难做到这一点,只能依靠生物技术,别无他法。”
与此同时,詹姆斯也在申请野外释放试验,但也遭到了各国政府的拒绝。就在科学家们走投无路的时候,开曼群岛伸出了援手。这是英国在加勒比海西印度群岛上的一块海外领地,距离大陆很远,不怕蚊子逃逸,监管也相对较松。艾尔菲说服开曼群岛政府批准了野外释放试验,结果当地的埃及伊蚊种群数量减少了80%,证明这个方法是有效的。

消息传出后,引来了很多非政府组织(NGO)的攻击。比如绿色和平组织就指责Oxitec不能保证所有雌蚊都会死,有可能导致基因扩散。但实际上转基因蚊子只能和野外的同类交配,基因不可能扩散到其他物种里去。只要这个基因还起作用的话,绝大部分雌蚊都会死,即使少量存活也不会影响最终效果,这是被实验结果证明了的。所以绿色和平组织的指责是毫无根据的,他们这么做的根本目的不是为了减少蚊媒传染病或者更好地保护生态环境,而是纯粹为了反对转基因。
“事实上,为了增加保险系数,我们在开曼群岛释放的是一种新型的转基因蚊子,产下的卵无论雌雄都会死,不会有任何残留风险。”艾尔菲对我说,“另外,开曼群岛政府在向民众宣传的时候只说这是一种新型的不育蚊子,没有提转基因这个词,这才终于获得了当地居民的同意。”
不过,除了这个小伎俩之外,开曼群岛之所以愿意进行这项实验,最根本的原因在于这个岛当时正遭遇一波登革热疫情,对灭蚊有着强烈的需求。实验成功之后,其他几个登革热疫情严重的国家和地区立刻主动找上门来,请求Oxitec去做实验,其中就包括马来西亚和巴西,以及美国的佛罗里达州。
其中巴西释放的是艾尔菲研制出的一种新型转基因蚊子,代号OX513A。这个品种的转基因蚊子转入了一个编码tTA蛋白的基因,这个tTA蛋白会和该基因本身的启动子相结合,从而开启了一个自杀性的正反馈,于是携带这个基因的卵就没办法正常发育了。
这次野外释放试验非常成功,于是巴西政府于2014年4月批准Oxitec公司在巴西正式销售这种转基因蚊子,使之成为第一个商业化的转基因SIT产品。不过,因为这种转基因蚊子寿命很短,必须每周释放一次,成本过于高昂,于是Oxitec在OX513A的基础上又研发出了一款代号为OX5034的新型转基因蚊子,只有携带新基因的雌蚊会死,雄蚊则安然无恙,可以和野生雌蚊交配,继续传播这个新的致死基因。

“OX5034的另一个好处就是我们不用自己释放转基因蚊子,而是可以直接卖蚊子卵。消费者只要购买一个装有蚊子卵的盒子,装满水后放在自家屋外,雌蚊的卵不会孵化,只有雄蚊才会孵化出来,然后它们就可以和自家附近的野生雄蚊竞争雌蚊了。”艾尔菲对我说,“我们一般会建议消费者把转基因蚊子和其他传统灭蚊产品结合起来使用,因为转基因蚊子最适合消灭那些被杀虫剂漏掉的蚊子,毕竟我们释放的转基因蚊子自己会飞,它们会主动寻找那些躲藏在犄角旮旯里的野生雌蚊,通过交配把它们的后代消灭掉。”
OX5034推出后很快就在巴西做了野外试验,成功后便迅速被巴西政府批准商用。在美国食品药品监督管理局(FDA)的支持下,包括佛罗里达州、得克萨斯州和加利福尼亚州在内的几个美国南方州也批准了OX5034的野外试验,目前还在等结果。荷兰政府则批准Oxitec在其海外领地萨巴岛(Saba)释放OX5034蚊子,用于预防登革热和寨卡热。
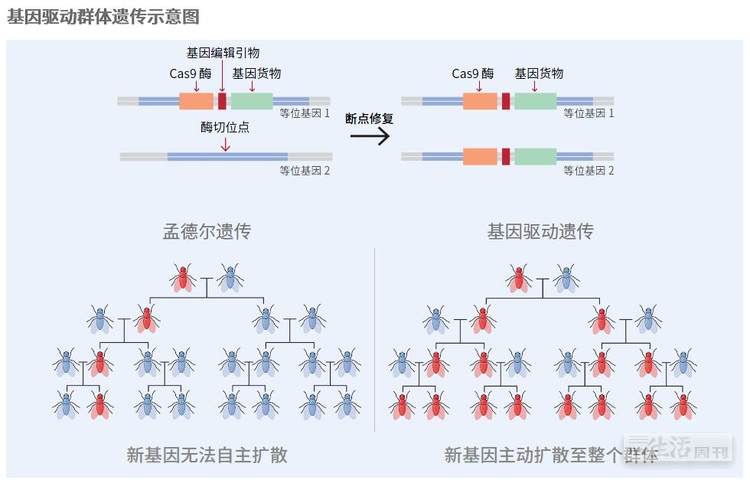
不过,最早开始转基因蚊子实验的开曼群岛却没有继续使用这项技术,原因不是这项技术不够好,而是太贵了。第一代转基因蚊子转入的基因都不具备自我增殖的能力,于是,按照孟德尔遗传定律,当携带新基因的雄蚊与野生雌蚊交配后,生下来的雄蚊当中只有一半会携带该基因,下一代又会再减半,直至彻底消失。
Oxitec公司的野外试验结果表明,即使像OX5034这样的新型转基因蚊子,在野外繁殖10代之后也会从环境中消失。对于那些害怕出事的人来说,这个机制相当于一种保险,因为它保证转基因蚊子不太会扩散到目标区域之外。但是,对于那些想要在目标区域内彻底消灭蚊子的人来说,这就意味着每隔一段时间都必须重新释放一次,灭蚊成本就上去了。
那么,有没有办法让这个灭蚊基因自我增殖,从而永远存在下去呢?答案是肯定的,这就是基因驱动(gene drive)。
新武器之三:基因驱动
我的第三站是位于伦敦自然历史博物馆旁边的伦敦帝国理工学院(Imperial College London),我的采访对象奥斯丁·博特(Austin Burt)博士已经在这里工作了将近30年。他原本是个加拿大人,博士学位也是在加拿大著名学府麦吉尔大学(McGill University)拿到的。在加州大学做了几年博士后研究之后,博特于1995年正式入职伦敦帝国理工学院,主攻基因驱动。

基因驱动的原理非常复杂,但目的却很简单,那就是要提高一个新基因在某个野生种群中的扩散速度。前文说过,任何一个新基因,只要经历一次有性生殖过程,其在种群中的占比就会减半,这是由孟德尔遗传定律所决定的,除非这个新基因具有某种生存优势,比如能够让后代更强壮。因此,如果某个新基因对种群生存没好处的话,它一定会随着时间的推移而逐渐减少,直至从种群中消失。
但是,早在上个世纪初期,科学家们就在自然界发现了很多“自私遗传因子”(selfish genetic elements),它们本身并不具备任何遗传优势,甚至反而对种群有害,但它们却能以高于孟德尔定律所规定的50%的概率遗传给下一代,直至扩散到整个种群。这些自私因子之所以能够做到这一点,根本原因就在于它们进化出了自我拷贝的能力,可以在有性生殖的过程中自发扩增。
我们可以用大家熟悉的一个案例来解释这一现象的原理。作家金庸在《射雕英雄传》第19回“洪涛群鲨”里讲过这样一个故事:一群人乘船离开桃花岛,中途遇到一大群鲨鱼,欧阳锋从随身携带的毒蛇嘴里提取了一小杯蛇毒,灌进一条鲨鱼的肚子里,然后将其放回海中。这条鲨鱼很快被其他鲨鱼分食,凡是吃了一块肉的鲨鱼都被毒死了,它们的尸体又被更多的鲨鱼分食,后者又都被毒死了,最终海面上所有鲨鱼都死光了。洪七公对此感到十分不解,欧阳锋解释说,他这条蛇的蛇毒有个奇怪的特性,那就是鲜血一遇上它就会化成毒药,因此只要一条鲨鱼的伤口碰到了毒液,这条鲨鱼身体内成百斤的鲜血便都被转化成了毒药。换句话说,这种毒药可以借助鲨鱼的血液实现自我增殖,只有这样才能无限地扩散下去,直至把整个种群全部毒死为止。
同理,如果我们把一个具备自我增殖能力的新基因引入某个动物种群,该基因能够像欧阳锋的蛇毒那样把它的同源基因也变成它自己,那么若干代之后这个基因就会传遍整个种群,这就是基因驱动的原理。
博特对这个概念非常着迷,他认为如果我们能找到一个办法,把某个对蚊子有害的基因做成驱动基因,让它在蚊子种群内实现自主扩散,就可以事半功倍地把该蚊子种群消灭掉。
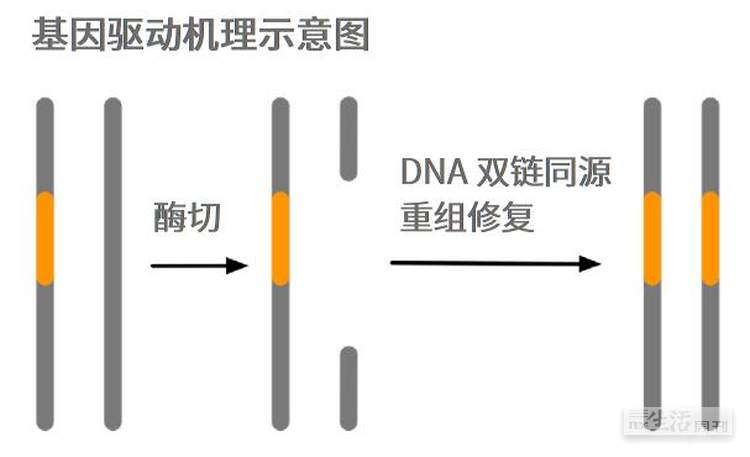
这么好的事情有可能实现吗?答案是肯定的,因为自然界就存在类似的驱动基因,比如酵母菌的“归巢内切酶”(homing endonucleases)基因就是一例。这是一种特殊的DNA内切酶,能够特异性地把编码自己的基因所对应的等位基因切个小口子。当细胞检测到这样的切口时,会用另外那条完整的染色体作为模板,通过基因同源重组的方式进行修补,于是编码该内切酶的基因就会被自动地复制过去,从而把两条染色体都变成归巢内切酶的编码基因。
举例来说,假设某个酵母菌细胞的第2号染色体的中间位置有一个归巢内切酶基因A,当这个细胞和另一个缺乏该基因的野生酵母菌细胞发生有性生殖时,合子(相当于受精卵)内会有一条包含A基因的2号染色体,以及一条不包含A基因的野生2号染色体,科学术语称之为杂合子。之后,合子细胞会以A基因为模板,合成出一些归巢内切酶,这个酶会专一性地在另外那条野生2号染色体的中间位置切个口子,于是细胞内的DNA修复机制被启动,以那条完好的、包含A基因的2号染色体为模板,将野生2号染色体的断口补上,A基因便在这一修补过程中通过同源重组的方式安插进了那条野生2号染色体的中间位置,从而把这个合子内的两条2号染色体全都变成携带A基因的纯合子。这个合子发育成酵母菌之后,会再通过有性生殖重复一遍上述过程,直到把周围环境中所有的野生酵母菌全都变成含有归巢内切酶的酵母菌为止。
博特受到这一现象的启发,设计了一个简单的基因驱动系统,只需通过基因工程的手段在蚊子的某条染色体上安插一个DNA内切酶基因(相当于卡车),然后再在这个基因的旁边安插一个科学家想要的基因,比如让雌蚊翅膀不发育的基因(相当于货物),就可以借助这个DNA内切酶的自我驱动能力,让这个雌蚊翅膀不发育基因通过搭便车的方式逐渐扩散至整个蚊子种群。
有了这个想法之后,博特教授从维康信托基金会(Wellcome Trust)申请到了一笔总数只有12.5万英镑的研究经费,通过大量的数学计算构建出了基因驱动的理论框架,并于2003年将这个框架写成论文发表了出来。按照博特的计算,这个方法可以用极低的成本,只需20代的时间,就让一个特定地区的蚊子种群走向灭绝,蚊媒传染病的问题自然也就迎刃而解了。

这篇论文改变了伦敦帝国理工学院的一位新晋博士生托尼·诺兰(Tony Nolan)的命运。诺兰原本的研究方向是转基因蚊子,读博期间他打算借助自然界已有的“跳跃基因”来实现基因驱动,但初步实验后发现难度太大,于是他转行干别的去了。博特的论文促使诺兰重新回到这个领域,和博特一起研究基因驱动。可惜当时没人愿意资助这样一个难度极大的新项目,更何况这个项目的最终目的是消灭蚊媒传染病,这对大部分发达国家来说早已不是什么大问题了。
恰在此时,比尔及梅琳达·盖茨基金会决定出资2亿美元(后来追加到4.5亿美元)开启一个“大挑战”(Grand Challenges)项目,面向全球征集大胆的创新技术或者方案,帮助发展中国家解决贫困人群的健康问题。利用生物技术控制蚊媒传染病是2004~2005年度的第一届“大挑战”项目所确立的14个目标之一,如果获批的话每个项目可以拿到2000万美元的资助,资助期限是5年。
“我当时没敢申请那么多钱,我提出的要求还不到这个数字的一半。”博特回忆道,“没想到我的申请很顺利地通过了,那是我到那时为止收到的最大的一笔科研经费。”
有了这笔启动资金,博特终于得以在伦敦帝国理工学院建立了自己的实验室,并组建了一个名为“消灭疟疾”(Target Malaria)的团队,开始研究如何利用基因驱动技术来对付疟疾。据他回忆,在此后的很长一段时间里,他的实验室是全世界唯一在做基因驱动研究的实验室。
诺兰就是这个研究团队里的一员,他和博特一起确认了基因驱动技术的可行性。“这项技术最大的难点就是如何寻找合适的DNA内切酶靶点,让DNA同源重组成为可能。其次就是如何方便地对DNA内切酶进行修饰,使之符合科学家们的设计要求。”如今已是利物浦热带医学院灭蚊项目主管的诺兰对我说,“我们通过研究证明这两个困难都是可以克服的,基因驱动完全有可能在蚊子身上实现。只不过我们当时所能使用的DNA内切酶都不太好用,要想构建出一个具备实用价值的基因驱动蚊子的难度相当大。”
虽然难度极大,但比尔及梅琳达·盖茨基金会一直没有停止对“消灭疟疾”团队的资助。8年之后,基金会的坚持终于有了回报,一项基于CRISPR-Cas9的基因编辑技术于2013年横空出世,第二年就有人用这个技术在果蝇身上实现了基因驱动,因为CRISPR-Cas9本质上就是一个易于操作的DNA内切酶,科学家们可以很方便地对这个酶进行修饰,让它像归巢内切酶那样驱动起来,从而实现对特定基因的添加、删除、干扰和修饰。
“受到果蝇实验成功的启发,我们用冈比亚按蚊(Anopheles gambiae)做了基因驱动实验,发现CRISPR-Cas9也可以用于这种蚊子。”诺兰对我说,“接着,我们又发现了一个绝佳的DNA内切酶靶点,刚好位于一个与雌蚊发育有关的基因内。于是我们设计了一个基于CRISPR-Cas9的基因驱动系统,能够特异性地把那个雌蚊发育基因破坏掉,但雄蚊却可以正常发育,从而让这个基因得以继续驱动下去。”
冈比亚按蚊是杀人最多的一种按蚊,因为它是最危险的恶性疟原虫(Plasmodium falciparum)的宿主。这种蚊子最喜欢野外环境,生活在小村庄里的非洲农民是其最大的受害者。这些非洲村落分布得非常零散,人工释放不育雄蚊的成本很高。Oxitec开发的第一代转基因蚊子需要不断释放才能奏效,所以不适合对付冈比亚按蚊。基因驱动属于第二代转基因技术,带有驱动基因的转基因蚊子理论上只需释放一次就能在环境中维持相当长的时间,这就大大降低了控蚊成本。事实上,“消灭疟疾”团队通过大量实验证明这套基因驱动系统只需释放一次,就可以在不到一年的时间里把实验室饲养的冈比亚按蚊群体尽数剿灭,不留一个活口。
实验结果发表后立刻引起了全球生物界的高度关注,因为这是人类发明的第一个能够自主地杀死一种特定野生动物的基因工程技术,理论上可以用于根治蚊媒传染病、防治农业害虫和消灭入侵物种等多个需要与野生动物打交道的领域,应用前景实在是太广泛了。
“如果没有CRISPR-Cas9工具的话,基因驱动也是可行的,但进展会非常缓慢。”博特对我说,“基因编辑技术的出现极大地降低了基因驱动的门槛,吸引了一大批科学家进入这一领域,从中诞生了很多有趣的应用。”
其中一项应用就是利用基因驱动的“带货”能力,将某个经过设计的新基因引入野生蚊子种群,使之不再能传播疟疾。博特实验室的研究人员通过实验发现,基于CRISPR-Cas9的基因驱动系统可以为冈比亚按蚊引入10~12kB的“基因货物”,大致相当于2~3个编码蛋白质的基因。之后,伦敦帝国理工学院的乔治·克里斯托菲德斯(George Christophides)利用这个基因驱动系统将两条短肽链引入冈比亚按蚊种群,延缓了疟原虫的发育速度。

“对蚊子传播疟疾的能力影响最大的因素之一就是雌蚊的寿命,其影响力随着蚊子寿命的增加而呈指数级增长,这是因为疟原虫通过第一次吸血进入蚊子肠道之后需要10~14天的时间才能成熟,而疟原虫只有在成熟之后才能从囊泡中冲出来并进入蚊子的唾液腺,再通过下一次吸血传染给下一个人。”克里斯托菲德斯对我说,“野外研究发现,只有不到10%的野生冈比亚按蚊雌蚊在第一次吸血之后还能再活10~14天,所以具备二次吸血能力的雌蚊都已经很老了。我们从蜜蜂和非洲爪蟾中找到了两个短肽链,能够在雌蚊的肠道内把疟原虫的成熟期再延长4~5天,绝大部分野生冈比亚按蚊都活不到那么久,所以疟原虫就没机会再传染了。”
总部同样设在伦敦帝国理工学院内的另一家旨在消灭疟疾的研究团队“零传染”(Transmission Zero)正在试图利用这项技术来遏制非洲疟疾的传播。从名字可以看出,这两个团队的使命虽然都是消灭疟疾,所使用的手段同样也是基因驱动,但技术细节有所不同。“消灭疟疾”团队试图通过灭蚊来实现目标,而“零传染”团队则希望斩断疟原虫的传播链条,从而在不影响蚊子种群数量的情况下消灭疟疾。
“基因驱动是个全新的技术,其对环境的影响存在很多未知数,所以我们决定采取一个折中方案,尽可能消除公众的疑虑。”伦敦帝国理工学院教授、“零传染”团队的一位负责人尼古拉·温德比希勒(Nikolai Windbichler)对我说,“我们甚至把整个团队分成了两组,一组专攻转基因,即如何把那两个短肽链基因转入蚊子基因组。另一组专攻基因驱动,即如何利用CRISPR-Cas9系统把目标基因驱动起来。等到时机成熟之后,两个小组一合并就行了。”
克里斯托菲德斯解释说,分组的好处主要是为了方便在非洲进行野外释放试验。非洲国家普遍对转基因技术缺乏了解,说服他们同意进行野外试验困难重重。不带驱动程序的转基因蚊子好歹已经在巴西和美国等国家做过野外释放试验,证明无论对人体健康还是对生态环境都没有负面影响,相对比较容易获批。基因驱动是个全新的技术,全球尚未有任何国家批准任何一项野外释放试验,要想在非洲获批难度极大。
那么,有没有什么办法能够在不使用基因工程技术的情况下让蚊子不再传播疾病呢?答案是肯定的,这就是共生菌。
新武器之四:共生菌
我的第四站是上海,我的采访对象是中国科学院昆虫发育与进化生物学重点实验室主任王四宝,他发现了两种蚊子共生菌,能够杀灭蚊子肠道内的疟原虫。

“我一直对蚊子共生菌的抗疟特性感兴趣,早在2012年就利用合成生物学技术把大肠杆菌的一个分泌系统转移到了蚊子肠道共生菌内,让后者不断地分泌抗疟多肽分子,抑制疟原虫在蚊子肠道内的生长。”王四宝对我说,“后来我转向大自然,开始寻找具备天然抗疟能力的蚊子共生菌,花了7年时间终于找到了。”
据王四宝介绍,他和中国疾病预防控制中心的科研人员合作,调查了中国的疟疾流行数据,发现云南腾冲地区虽然有较多的输入型疟疾病例,但却几乎没有在当地流行开来,他猜测这是因为腾冲的蚊子体内生活着某种能够抵抗疟原虫的共生菌,进一步研究证实了他的猜测。
“我们从腾冲蚊子的肠道里分离出了两种具备抗疟活性的共生菌,其中一种是粘质沙雷氏菌,可以通过激活蚊子的天然免疫系统间接抑制疟原虫的生长。”王四宝对我说,“另一种是解脲沙雷氏菌,它能生产一种脂肪酶,把疟原虫的细胞膜破坏掉,从而直接杀死疟原虫。”
“为什么这种脂肪酶不会破坏蚊子本身的细胞膜呢?”我问。
“这是因为当蚊子吸血后,生活在蚊子肠道中的解脲沙雷氏菌就会分泌一种囊泡,脂肪酶就是被装载在这种囊泡里进入肠道环境的。而这种囊泡表面含有大量脂质成分,这正是疟原虫最喜欢吃的东西。”王四宝解释说,“要知道,疟原虫是一种寄生虫,多年的寄生生活让疟原虫丢失了合成脂肪酸的能力,因此它所需的脂肪酸只能从环境中摄取。当疟原虫遇到富含脂质的囊泡时会主动将其吞噬,于是囊泡里的脂肪酶就会被特异性地释放到疟原虫体内。”
这套机制是王四宝团队经过多年研究之后才搞清楚的,他还发现了一种特殊的感应分子,能够协调共生菌统一释放囊泡,提高其在蚊子肠道内的定植能力。

更妙的是,这两种肠道共生菌都是好氧细菌,可以用最简单的细菌培养液进行扩增,也可以在野外环境中存活很长的时间。于是王四宝设想把这两种共生菌饲养在含糖溶液中,引诱野生蚊子食用,或者教当地人大批量生产共生菌,然后把共生菌投放到水塘或者沼泽地等幼蚊孳生地,通过这两个方法把腾冲蚊子的抗疟特性传递给非洲蚊子。另外,他还在研究如何利用他发现的那种感应分子帮助共生菌更好地在非洲蚊子的肠道内定植。
“我们已经把解脲沙雷氏菌的菌株寄给了布基纳法索的同行,他们通过实验证明这个菌株可以很好地和当地蚊子共生。”王四宝对我说,“我们还证明这个菌株不但可以通过交配从雄蚊水平传递给雌蚊,还可以通过蚊子卵从雌蚊垂直传递给下一代,所以理论上只需很少的几次野外释放就能持续扩散,使用成本极低。”
王四宝并不是第一个意识到共生菌价值的人,早在几十年前就有人发现一种名为沃尔巴克氏体(Wolbachia)的微生物具备抑制蚊媒传染病的潜力。沃尔巴克氏体是自然界分布最广泛的一种共生菌,至少一半的昆虫是它的潜在宿主。这种共生菌有很多亚型,会导致宿主出现细胞质不兼容(Cytoplasmic incompatibility)现象,即感染了其中某一种亚型的雄性昆虫不能与未感染或者感染了另一种亚型的雌性产生后代。中山大学的奚志勇教授利用了沃尔巴克氏体的这一特性,于2014年在广州市南沙区的一座小岛上释放了一批感染了一种新型沃尔巴克氏体的雄蚊,希望它们与岛上已有的、感染了另外两种沃尔巴克氏体的雌蚊交配,产生不育后代。实验非常成功,岛上的白纹伊蚊(Aedes albopictus)数量在两年的时间里减少了94%。
除了让蚊子不育之外,沃尔巴克氏体还能抑制病毒的生长和扩散。几位澳大利亚科学家最先在一个澳大利亚小村庄进行了野外试验,证明感染了沃尔巴克氏体的埃及伊蚊不再具备传染登革热的能力了。接下来他们又在越南的几个小村庄和一座印尼小城市进行了几次小规模野外释放试验,发现那些释放了感染沃尔巴克氏体蚊子的地区比对照组减少了77%的登革热病例和86%的住院病人。
这个消息让备受登革热困扰的哥伦比亚看到了希望。在国际抗疟机构的支持下,该国第二大城市麦德林(Medellín)投资建设了一座蚊子工厂,花了7年时间把产量提高到了每月100万只的水平。2017年8月,麦德林市进行了到那时为止全球规模最大的一次蚊子释放,工作人员在两个月的时间里释放了200万只感染了沃尔巴克氏体的雌蚊。因为释放量太大,政府不得不动用了无人机,这才达到每50米见方的区域内至少释放150只蚊子的水平。

这次释放的效果相当不错,至少有三分之二的麦德林埃及伊蚊感染了沃尔巴克氏体。登革热一般每4~6年有一次高峰,2021年预计是登革热大年,但麦德林市的登革热感染率却一直维持在很低的水平,预想中的感染率高峰没有出现,证明这个方法是有效的。于是哥伦比亚政府决定在另一座大城市卡利(Cali)重复这一过程,效果也不错。
看上去形势一片大好,唯一的问题就是成本太高了。埃及伊蚊很难感染沃尔巴克氏体,工作人员只能通过手工方式将含有沃尔巴克氏体的溶液注射进雌蚊的卵,导致蚊子工厂的生产成本居高不下。再加上沃尔巴克氏体无法通过交配或者食物传播,释放时只能以量取胜,这就进一步增加了成本。那次麦德林控蚊行动的官方公布成本为每人不到3美元,但根据《纽约时报》的报道,那次行动的实际耗资很可能高达每人15美元。考虑到麦德林市的总人口超过了250万,这是一笔不小的投资。
即便如此,共生菌仍然比传统的SIT更省钱,因为沃尔巴克氏体具备繁殖能力,可以持续地进行自发扩散,不需要每个月释放一次。事实上,共生菌和基因驱动非常相似,两者都可以自主增殖,理论上都不需要任何后续工作就可以达到目的。我们甚至可以把共生菌看作是一种转入了很多外来基因的基因驱动系统,只不过这些转入的外来基因自发组成了一个相对独立的生命个体而已。
有意思的是,很多人强烈反对转基因或者基于转基因技术的基因驱动,却对共生菌没有意见,甚至认为后者是一种更加“环保”的干预自然方式,这说明这些人担心的并不是大自然是否会遭到破坏,而是基因工程技术本身,因为这项技术是由生物学家们发明出来的,反对者不喜欢有人“扮演上帝”。
大部分这类反对者都是虔诚的宗教信徒,但他们的反对却导致很多没有宗教信仰的普通民众无法享受新技术带来的好处。比如,我们很容易发现基因驱动在以下三个方面比沃尔巴克氏体更强。首先,基因驱动技术不需要注射虫卵等额外操作,蚊子的生产成本可以降到极低的水平,理论上要比沃尔巴克氏体便宜得多。其次,基因驱动既可以通过雌蚊产卵垂直传播,又可以通过雌雄交配水平传播,其传播效率远高于沃尔巴克氏体。再次,也是最重要的一点,那就是沃尔巴克氏体只对伊蚊有效,按蚊当中目前只有斯氏按蚊能与沃尔巴克氏体共生,最危险的冈比亚按蚊无效,所以沃尔巴克氏体目前只能用来对付登革热和寨卡热等病毒性传染病,无法用于控制疟疾。
王四宝在腾冲发现的那两个共生菌似乎完美地解决了沃尔巴克氏体的所有问题,但他毕竟只在实验室环境里做过实验,还没有在野外做过测试,不知道这两种共生菌能否适应非洲当地的自然环境,也不知道这两种共生菌能否竞争得过非洲的本地细菌,更不知道这两种共生菌能否和冈比亚按蚊维持长时间的共生关系,会不会对其他非洲昆虫造成不好的影响,所有这些问题都必须通过长时间的野外释放试验才能得到解答。
据王四宝介绍,他们实验室已经和布基纳法索建立了合作关系,正在申请去那个国家开展“半现场”(Semi-Field)共生菌释放实验,即在当地建立一个有蚊帐的室外实验室,考察这两种共生菌能否适应当地的高温、水源、昆虫和植被等自然条件。这样的实验至少需要进行1~2年的时间,所以他们实验室正在着手培养当地的科研人才,希望有朝一日能把这项技术全部转移到非洲去,让非洲人自己学会培养并释放共生菌。
最后这点非常重要,因为已有无数事实证明,要想消灭某个地方的蚊媒传染病,必须有当地人的全力配合才能成功,这在教育水平和经济状况都相对较差的非洲可不是一件容易的事情。
新武器之五:全民动员
我的第五站是塞内加尔首都达喀尔,2023年“大挑战”年度大会就在这里举行。这是“大挑战”首次在非洲举办年会,到场的非洲代表人数创了纪录。蚊子是此次大会的绝对主角,主会场入口处展出的一位非洲装置艺术家的两件作品全都是关于蚊子的,比尔·盖茨(Bill Gates)在开幕式上的发言也多次提到了蚊子,他还展望了基因驱动技术在控制蚊媒传染病方面的巨大潜力。WHO代表则在一个主要针对非洲国家的边会上详细解释了转基因蚊子和基因驱动的技术细节,以及各自的优缺点。
按照WHO代表的说法,转基因蚊子最大的好处就是专一性强,不伤及无辜。次要好处就是可以触及杀虫剂无法覆盖的地区,还能有效弥补蚊帐和电风扇等驱蚊工具的防御盲点。另外,转基因蚊子主要由专门的防疫人员负责释放,无需当地人购买任何东西,或者改变其日常行为模式,理论上对老百姓的经济状况和配合程度要求很低,也不太会被政局不稳或者经济衰退等其他客观因素所影响。
以上这些说法全都来自WHO于2021年5月19日颁布的第二版《转基因蚊子试验指导纲要》(The Guidance Framework for Testing Genetically Modified Mosquitoes),这份纲要按照最终目的的不同把转基因蚊子分为种群抑制(population suppression)和种群替换(population replacement)这两类,前者就是通过引入致死基因来抑制蚊子的种群数量,前文提到的“消灭疟疾”团队的技术路线即属此类。后者则通过引入新的基因来减少蚊子携带或者传播病原体的能力,前文提到的“零传染”团队的技术路线就是这一类的代表。
和2014年颁布的第一版不同的是,第二版纲要加入了大量与基因驱动有关的内容。我专门采访了第二版的主要作者之一迈克尔·桑托斯(Michael Santos),他是美国国立卫生研究院基金会(FNIH)下属的一家名为“基因召集全球协作组织”(The Gene Convene Global Collaborative)的负责人。在他看来,转基因蚊子也可以按照技术路线的不同分为自限性(self-limiting)和自驱性(self-sustaining)这两类,前者会导致引入的新基因逐渐减少,需要不断释放新的转基因蚊子才能达到效果,前文提到的Oxitec公司的转基因蚊子就属于这一类。后者其实就是基因驱动,这项技术最大的优点就是一次释放持续的时间长,控蚊成本低,缺点是一旦出现问题就难以收回了。
桑托斯告诉我,一般人提到的基因驱动都是指“低阈值自维持基因驱动”(low threshold self-sustaining gene drive),即只需释放极少的个体就能让基因驱动持续进行下去。如果没有其他因素影响的话,这种基因驱动每过一代其基因频率都会加倍,很像导致原子弹爆炸的核裂变反应,如果出问题的话处理起来会比较麻烦。无论是当地民众还是负责审批的政府官员最害怕的就是失控,所以截止到目前全世界还没有任何一项具备基因驱动能力的转基因蚊子被批准进行田野实验。
“为了解决这个问题,科学家们已经开发出了能够自行中止的基因驱动技术,野外释放之后一段时间内就会自动停止扩增。”桑托斯对我说,“这么做相当于为基因驱动技术加了一层保险,主要目的就是为了赢得政府官员和民众的支持,否则的话这项技术是没办法应用的。”
“大家的担心是有道理的吧?假如科学家把包含致死驱动基因的蚊子释放到野外,理论上会让蚊子灭绝,这会不会对生态系统造成负面影响?”我问。
“地球上现存3500多种蚊子,其中生活在两极地区的蚊子数量非常多,有可能扮演某种显著的生态角色。但在地球的其他大部分地方,会咬人的蚊子数量很少,能够适应城市生活的蚊子就更少了,这是因为人类才进化出来没几年,城市更是很晚才出现的,蚊子还没来得及适应。”桑托斯对我说,“咬人的蚊子当中,能够传播疟疾的主要就是冈比亚按蚊、斯氏按蚊和致命按蚊(Anopheles funestus)这三种,传播登革热和黄热病的也只有埃及伊蚊和白纹伊蚊等少数几种蚊子,它们在大部分地区都属于入侵物种,因为它们原本就是跟着人类的足迹从非洲的某个地区传播到世界其他地方的,杀死这样的蚊子无论从生态上讲还是从道德上讲都没有问题。”
为了确认这一点,我又通过连线的方式采访了英国牛津大学的生态学家泰尔雅·哈克特(Talya Hackett),她领导的一个团队在加纳做了6年野外考察,确认冈比亚按蚊在当地生态系统中的作用极其有限。
“我们通过统计昆虫数量的方式构建了一个当地陆生和水生昆虫清单,在6万只昆虫当中只发现了6000只双翅目昆虫(即蚊蝇),其中只有4只是疟蚊。”哈克特对我说,“我们又花了一整年的时间收集了很多蚊子的天敌,包括蝙蝠、鸟类、蜘蛛、螳螂、壁虎、鱼类、蝌蚪、蜻蜓和蜻蜓若虫(幼体)等等,分析了它们的粪便和胃容物,发现冈比亚按蚊最多只占2%。其中生态地位比较重要的鸟类和蝙蝠的胃里没有发现一只疟蚊,吃过疟蚊的蜻蜓也只占当地蜻蜓数量的1%。所以我们有充分的理由相信,如果冈比亚疟蚊完全消失的话是不会对当地生态系统造成显著影响的。”
哈克特实验室的一名博士研究生还花了800多个小时观察野生蚊子和开花植物之间的关系,没有发现疟蚊身上粘有花粉,也没有观察到疟蚊停留在花的柱头上。这种蚊子通常只会停留在花的背面,喝从花上流下来的糖水,因此消灭疟蚊对当地开花植物的传粉机制也不会造成影响。
“其实人类早就在尝试用各种方法消灭蚊子了,比如墨索里尼为了控制疟疾不但填平了意大利的湿地,还向环境里喷洒了大量化学杀虫剂,这么做导致的生态代价直到现在都无法准确估量,即使有问题也已经无法挽回了。”哈克特说,“相比之下,基因驱动不但更环保,而且也更容易追踪其效果,如果出问题的话科学家还来得及补救。”
“我曾经看到过一种说法,认为疟疾等热带病挡住了伐木工人,否则非洲的热带雨林早就被砍光了。”我问哈克特,“这个说法当然非常政治不正确,但你认为这个说法有道理吗?”
“没道理,因为疟蚊都是跟着人跑的,没有人的地方自然也就没有疟蚊,所以妄想依靠疟蚊来保护原始森林的想法是错误的。”哈克特回答,“另外,现代伐木工人掌握了多种灭蚊技术,他们是不会被蚊子吓跑的。”
基因驱动技术的发明者博特也对彻底消灭疟蚊表示支持。“我来自加拿大的温尼伯,那地方以前夏天很难在外面待,因为蚊子太多了。后来在老百姓的支持下,当地政府喷洒了大量杀虫剂,我们终于可以在外面乘凉了。”博特对我说,“这件事说明,即使蚊子不传播疾病,人们也不愿意被蚊子叮咬,更何况是传播疾病的蚊子。一些西方人很喜欢强调保护环境,但他们是在隔岸观火,没有意识到这些蚊子给非洲人民带来了巨大的痛苦,所以我认为应该由非洲当地人来决定到底采用哪种方法灭蚊。”
在非洲工作过多年的哈克特曾经多次征询过当地人的意见,发现非洲人大都支持彻底消灭蚊子。“他们很可能因为某些环保组织的宣传而反对过转基因农业,也听不懂基因驱动的技术细节,但当我们通过漫画和视频等方式向他们解释基因驱动可能导致的后果之后,他们大都表示支持,因为他们被疟疾折磨得太久了。”哈克特对我说,“一些西方学者写文章说非洲不需要转基因,我对这类说法不做评价,但我自己永远不会代表非洲人说话,我只负责提供可靠的科研数据和科学证据,帮助非洲人做出对自己最有利的选择。”
桑托斯也认为最终需要由非洲人来决定采用何种技术,而他所在的“基因召集全球协作组织”在非盟发展组织(African Union Development Agency)的帮助下,把疟疾疫情最严重的几个西非国家组织起来成立了一个合作组,共同制定转基因蚊子的野外试验规则。
“蚊子没有国界,释放基因驱动蚊子的影响范围尤其广泛,需要很多国家联合起来一起行动。”桑托斯对我说,“要想做到这一点,首先需要做好知识普及工作,让广大民众不再惧怕新技术。很多疫苗之所以在非洲推广不下去,主要原因就是不少非洲人认为疫苗都是通过基因工程技术制造出来的,他们对这项技术感到恐惧。”
桑托斯特别希望我能为读者传递这样一个信息,那就是基因驱动其实不太可能把某一种蚊子全部杀死,因为科学家们通过数学模型的模拟发现了一种“追逐”(Chasing)现象,使得基于致死基因的基因驱动永远没有办法杀死一个自然种群中的所有个体,总会有漏网之鱼。

为了理解这个“追逐”现象究竟是如何发生的,我专程去北京大学采访了正在该校任教的美国遗传学家杰克逊·钱珀(Jackson Champer)。他早在2016年就开始研究基因驱动技术,2022年应聘来北大任教,顺便把这项技术带进了中国。目前国内还有几家实验室在研究基因驱动,但只有他这一家实验室在研究按蚊的基因驱动。
钱珀在电脑上为我演示了那个数学模型的运作过程。简单来说,基于种群抑制的基因驱动相当于把携带两个致死基因的雌蚊从种群中去除掉,这样一来野生雌蚊就有了一定的生存优势。只要基因驱动蚊子的活动能力没那么强,一定会有少数野生雌蚊躲过基因驱动的攻击而幸存下来。这些野生雌蚊会通过交配壮大自己的势力,直到基因驱动蚊子再次发动下一轮攻击为止。整个过程很像是警察在“追逐”小偷,虽然警察配备了强大的武器装备,但小偷遍布全城,行动灵活,生存能力更强,总会有几个漏网的。
“因为实验室饲养的蚊子种群规模很小,所以实验结果和真正的野外释放差异很大。即使我们开发出的某种基因驱动蚊子在实验室环境里能够达到100%的灭蚊效果,野外释放的效率很可能会下降到只有70%。”钱珀对我说,“所以我们的目标应该是尽可能在实验室阶段提高种群抑制的效率,因为实际应用时往往会打一个很大的折扣。”
换句话说,如果科学家们为了照顾民众的情绪而故意降低基因驱动的效率,比如前文提到过的能够自行中止的基因驱动,那么最有可能出现的结果就是控蚊效率达不到设计要求,导致最终不得不多次重复释放。这样一来,基因驱动的最大优势就没有了。
野外试验和实验室试验的另一个重要差别就是前者会出现抗性,这是生物进化必然导致的结果,任何人都难以改变。事实上,包括杀虫剂和SIT在内的各种灭蚊措施之所以没能彻底终结蚊媒传染病,最根本的原因就是蚊子进化出了抗性。对于基因驱动来说,最有可能出现的抗性就是CRISPR-Cas9的酶切位点发生基因突变,导致这个酶切不下去,于是基因驱动停止。钱珀实验室尝试为CRISPR-Cas9多找几个酶切位点,即使一个位点发生变异,另外的位点仍然可以继续工作。初步实验证明此法确实有效,但还没有经过野外释放试验的检验。
博特领导的“消灭疟疾”团队采用了另一个方法对付这种情况。他们把CRISPR-Cas9的酶切位点设在一个与雌蚊健康关系密切的基因内部,如果这个基因发生了突变,虽然基因驱动会受影响,但雌蚊也会因此而死亡,而这正是基因驱动想要达到的效果,所以这样的基因突变对最终结果影响不大。
“无论事先的设想有多么完美,抗性也一定会出现,所以我认为我们最应该做的就是不断研制新的基因驱动蚊子品种。一旦野生种群出现抗性,那就释放一个新品种,保证基因驱动能够继续进行下去。”博特对我说,“事实上,这就是转基因技术的优势所在。因为化学杀虫剂的研发周期很长,一种新杀虫剂往往需要10年以上的时间才能研发出来,但基因驱动的迭代速度非常快,我们很容易针对突发情况做出相应的改进。”
基于同样的原因,博特更支持种群抑制,因为这个技术路线的目标是减少蚊子数量,这就降低了抗性出现的概率。相比之下,种群替换技术路线本身是没有问题的,但却给抗性的出现留了一个很大的口子。
虽然博特是基因驱动技术的发明人,但在采访过程中他很少谈论基因驱动的理论问题,而是花了大量时间跟我描述非洲现场的情况。他告诉我,“消灭疟疾”团队早在2019年就在布基纳法索进行了非洲大陆第一次转基因蚊子的野外释放试验,虽然那次释放的是不育雄蚊,实验目的也不是为了测试转基因蚊子是否有用,而是为了看看这种蚊子到底能飞多远。
“我们通过那次野外释放试验培养了一批非洲技术人员,也让当地人为将来真正的野外释放试验做好心理准备,这是基因驱动技术进入实用阶段的必经之路。”博特对我说,“事实上,比尔及梅琳达·盖茨基金会的重点也一直是放在应用上的。虽然盖茨也鼓励我们发论文,但他一直强调基金会资助我们的最终目的是应用,所以我们花了很多时间和精力用于和非洲民众交流,宣传我们的理念,希望获得他们的支持。”
同样受到比尔及梅琳达·盖茨基金会支持的“零传染”团队也把工作重点放在了应用上。他们之所以把基因驱动项目分成了转基因和基因驱动这两部分,一个主要原因就是为了让相对安全的转基因小组先去非洲做实验。这么做一方面可以获得非洲政府和民众对转基因技术的信任,另一方面也可以借机培养当地人才,以便将来可以让当地人全盘接手,不再需要从西方引进技术和资金了。
那么,如果我们从实用的角度考察上文提到的那些灭蚊新技术,究竟哪个最有前途呢?答案并不是那么显而易见的。基于种群抑制的基因驱动技术从纸面上看似乎是最好的,但这项技术太过先进,不太容易获得各国民众的支持和政府的认可。基于共生菌的技术比较容易获得批准,但迄今为止尚未有任何一种蚊媒传染病是被这项技术所消灭的,所以该技术的可行性和实用性有待检验。基于种群替换的基因驱动技术似乎介于两者之间,但这种技术不会影响野生蚊子的数量,不太容易让老百姓看到效果,并不一定能够获得广泛的支持。
我们可以用大家熟悉的案例做个比喻:种群抑制和种群替换这两种技术路线的关系很像是纯电车和混合动力汽车之间的竞争,前者代表了未来,但里程焦虑会吓跑很多消费者。后者属于过渡形态,早晚会被淘汰,所以也会吓跑另一部分追求一步到位的消费者。因此现阶段应该允许这两种技术路线并行,因为我们发展电动车的最终目的不是淘汰油车,而是遏制气候变化。任何一项新技术,只要能减少温室气体排放,都是应该被鼓励的。
具体到灭蚊技术,我们的最终目的并不是消灭蚊子,而是消灭传染病。任何一种传染病要想扩散开来,其传染指数(R0)必须大于1才行。任何一项灭蚊技术,只要能够把R0降到1以下就可以了,并不一定非得把蚊子消灭干净。无数历史事实证明,只要想办法把全体老百姓动员起来,增强大家的灭蚊意识,消除大家对新技术的恐慌情绪,消灭蚊媒传染病并不是一件不可能的事情。
结语
基因驱动是目前最新的一种灭蚊技术,非洲则是经济发展最为落后的地区,两者似乎存在一种天然的矛盾,但这恰恰说明只有科学技术才是最平等的。
“此前大部分新技术确实都是由发达国家率先使用的,但这并不是真理,为什么非洲就不能率先引入一项新技术呢?”克里斯托菲德斯对我说,“事实上,很多国家都需要使用基因驱动技术来消灭入侵物种,但因为各种原因,发达国家对于这项新技术的使用感到非常犹豫。相比之下,消灭疟疾是基因驱动技术阻力最小的一项应用,所以我认为这项技术最有可能率先在非洲得到应用。”
确实,随着人口的不断增长,人与自然之间的矛盾越来越激化,我们迫切需要一种更精准的操控野生动物的方法。灭蚊技术有机会成为这个领域的先驱,帮助我们更好地与大自然和谐相处,共同繁荣。
(参考资料:朱石生,《人类与病》丛书;蒂莫西·瓦恩加德,《命运之痒:蚊子如何塑造人类历史》)
文章作者


袁越
发表文章519篇 获得0个推荐 粉丝4116人
《三联生活周刊》资深主笔
现在下载APP,注册有红包哦!
三联生活周刊官方APP,你想看的都在这里








